どうも。こんにちは。
ケミカルエンジニアのこーしです。
本日は、蒸気圧についてわかりやすく解説していきます。
この記事を読むことで、圧力と沸点の関係を理解することができ、また目的物質の蒸気圧曲線も描けるようになります。
本記事の内容
・蒸気圧とは
・蒸気圧曲線とは
・圧力と沸点の関係
・蒸気圧の求め方
・アントワン係数一覧
・計算例(蒸気圧・沸点)
この記事を書いた人
 こーし(@mimikousi)
こーし(@mimikousi)
蒸気圧とは
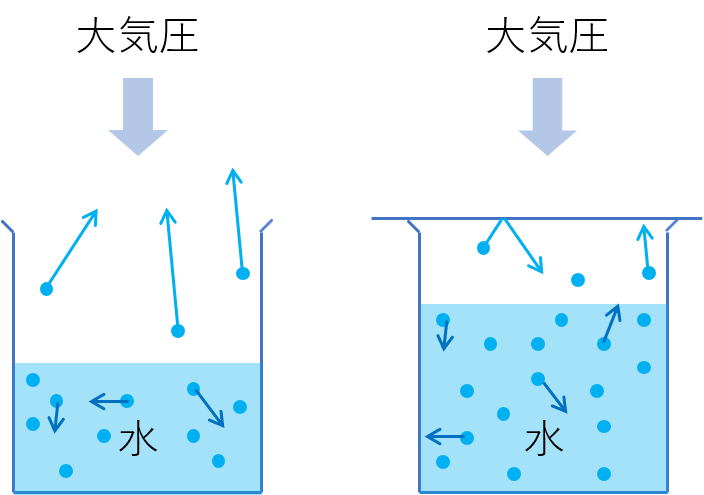
蒸気圧とは、分子の運動により液体が気体になろうとする力(圧力)のことです。
雨が降ったあとの水溜まりって、いつの間にか無くなっていますよね。
排水溝に流れたわけではなく、蒸発して空気中に消えています。
沸騰していなくても、液体は分子の運動により蒸発してしまうのです。
それでは、ビーカーに水を入れてみます。
ふたをしていないビーカーの水は、蒸発し、時間が経つと量が減っていきます。
一方、ふたをしたビーカーでは、一部の分子が液体から気体になりますが、ふたに邪魔されてビーカーの中にとどまっています。
このとき、ビーカーのふたを押し上げようとする力が「蒸気圧」となります。
蒸気圧は、「飽和蒸気圧」とも言います。
蒸発速度は速いので、基本的に「蒸気圧=飽和蒸気圧」と考えて良いですね。
蒸気圧曲線とは
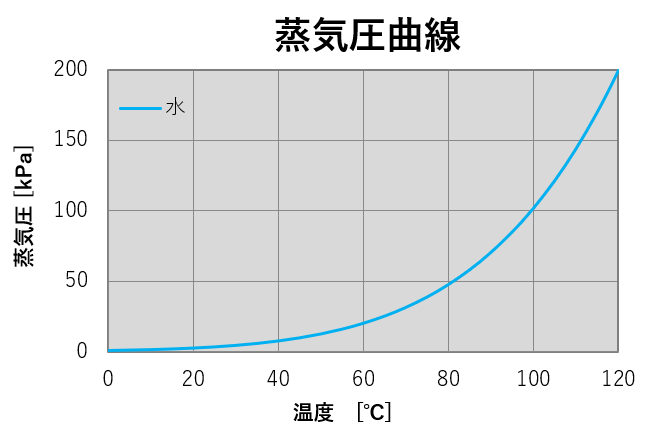
蒸気圧は、分子の運動の激しさによって決まります。
よって、上図のように蒸気圧は温度の関数になります。
横軸に温度、縦軸に蒸気圧を取ったグラフを「蒸気圧曲線」といいます。
温度を高くすればするほど、分子の運動は激しくなり、蒸気圧も大きくなります。
圧力と沸点の関係
「富士山の山頂で食べるカップラーメンはまずい」
と耳にしたことはありませんか?
富士山の山頂では、麺が硬く、ぬるいカップラーメンが出来上がります。
体験したことのない方は、実験動画がありますので、本当かどうか確認してみてください。(倍速にしたら約2分です)
なぜ富士山の山頂では麺が硬く、ぬるいカップラーメンが出来上がるのでしょうか。
それは、富士山の山頂では気圧が低いため、水の沸点が低くなり、ぬるいお湯しかできないからです。
富士山の気圧が低い理由
空気は、ほんの少しだけ質量を持っているため、上空の空気量が多ければ多いほど、圧力が大きくなります。
富士山の山頂では、上空の空気量が地上(海抜0m)に比べて少ないため、気圧が下がります。
・地上では、101.3 kPa ( = 1013 hPa)
・富士山の山頂では、63 kPa
となります。
沸点が低くなる理由
次に、沸点が低くなる理由について蒸気圧曲線を用いて解説してみます。
まず、沸点について説明しておきます。
沸点とは、外圧と蒸気圧が一致する温度のことです。
温度が上がり、蒸気圧が外圧と同じ圧力まで上昇しますと、大気を押しのけてどんどん蒸発するようになります。
この現象を「沸騰」といい、沸騰する温度が「沸点」となります。
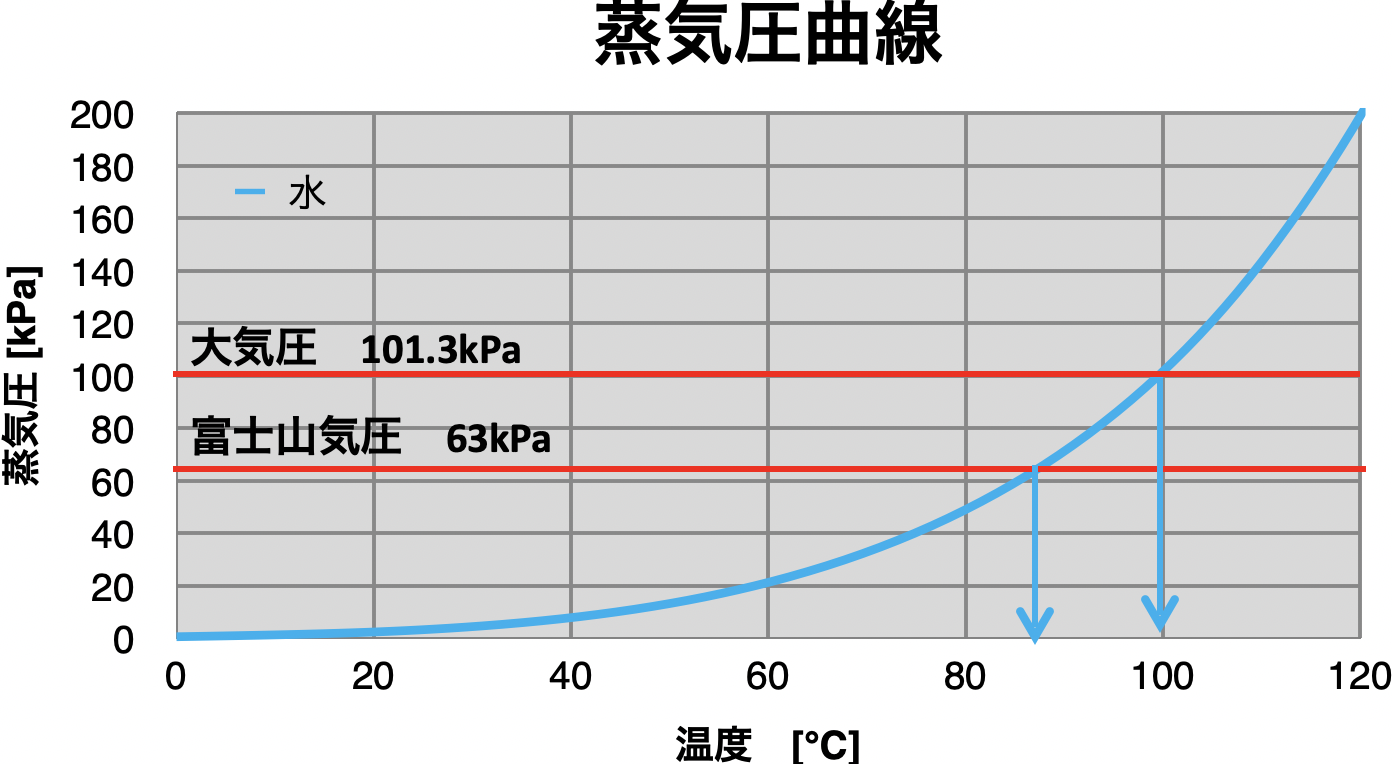
それでは、水の蒸気圧曲線を見てみましょう。
大気圧(101.3 kPa)のとき、水の蒸気圧が101.3 kPaとなるのは、100℃(沸点)のときです。
一方、富士山の山頂における気圧は63 kPaですので、水の蒸気圧が63 kPaとなるのは、87℃(沸点)のときです。
よって、外部の圧力が低くなると、沸点も同様に低くなることがわかりました。
蒸気圧の求め方
それでは、蒸気圧を求めてみましょう。
蒸気圧の求め方は、ざっくり下記3つの方法があります。
1.化学工学便覧などの教科書に掲載されているアントワン係数を使用する
2.プロセスシミュレータのデータバンクを利用する(Aspen Plus、PROⅡなど)
3.実験で求める
上記全てのケースでアントワンの式を使用しますので、アントワンの式について解説します。
(2や3の方法でも数式化しておいた方が便利ですので、アントワンの式を使用します)
アントワン(Antoine)の式
\(P\) : 蒸気圧 [Pa]
\(A\) : アントワン係数
\(B\) : アントワン係数
\(C\) : アントワン係数
\(T\) : 温度 [K]
※ 化学工学便覧の単位に合わせました。
(1)式を変形し、蒸気圧を求めますと、下記(2)式となります。
$$P=\exp \left( A-\frac{B}{C+T}\right)\tag{2}$$
(2)式にアントワン係数\(A\)、\(B\)、\(C\)と温度\(T\)を代入することで、蒸気圧\(P\)を求めることができます。
アントワン式の注意点
1.教科書によって、アントワンの式の単位が異なる
2.アントワン係数には適用温度範囲がある
蒸気圧の単位は、kPaやatm、mmHgであったり、また温度の単位は、Kや℃だったりします。
どのような式(単位系)のアントワン係数なのかを必ず事前に確認しましょう。
また、適用温度範囲外では、蒸気圧が当然ズレてきます。
アントワン係数一覧
化学工学便覧に載っているアントワン係数を一部紹介します。
| 物質名 | A | B | C | 適用温度範囲 K |
| 水 | 23.1964 | 3816.44 | -46.13 | 284 - 441 |
| シクロヘキサン | 20.6455 | 2766.63 | -50.50 | 280 - 380 |
| メタノール | 23.4803 | 3626.55 | -34.29 | 257 - 364 |
| ベンゼン | 20.7936 | 2788.51 | -52.36 | 280 - 377 |
| エタノール | 23.8047 | 3803.98 | -41.68 | 270 - 369 |
化学工学便覧(改訂七版)より引用
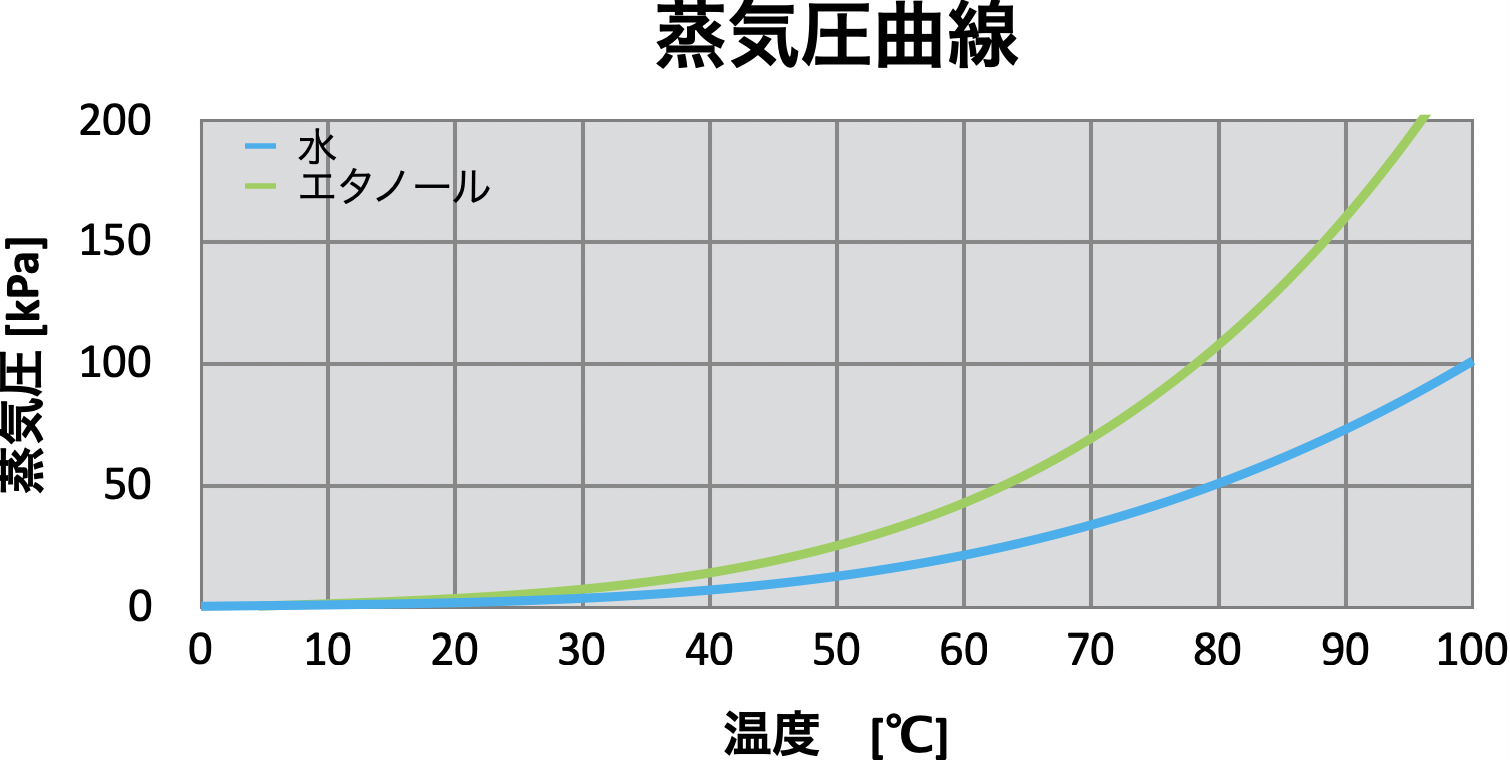
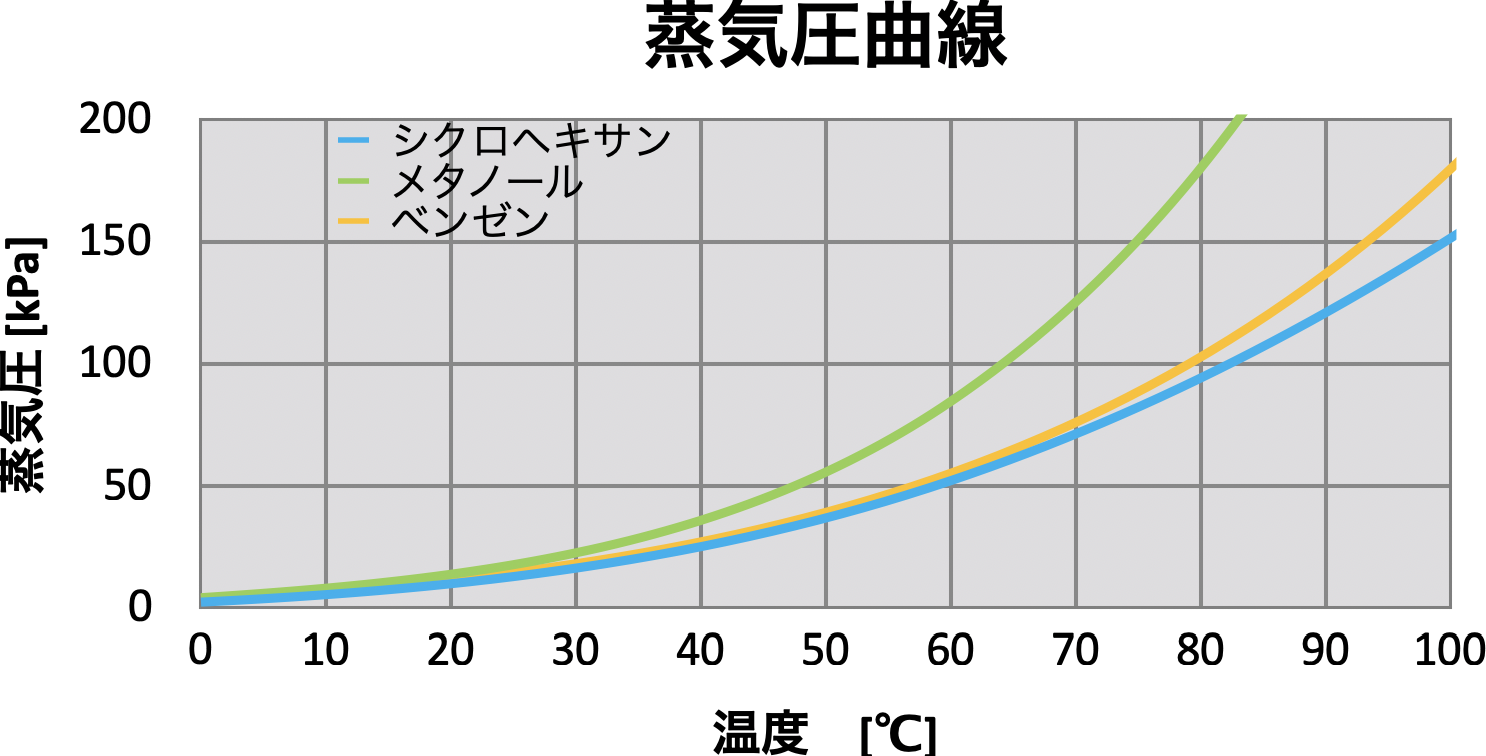
アントワン係数を用いて、蒸気圧曲線を作成すると下図のようになります。
上のグラフからわかるように、物質によって蒸気圧が異なります。
蒸気圧が大きい物質ほど、沸点が低くなります。
計算例(蒸気圧・沸点)
それでは、復習のための例題を2問出します。
計算例①
【問題】
富士山の山頂(気圧63 kPa)における、ベンゼンの沸点は何℃になるでしょうか。
アントワン係数は、前章の「アントワン係数一覧」の表を参照してださい。
【解答】
(1)式を変形して、蒸気圧が63 kPaとなる温度を求めます。
$$\begin{aligned}\ln P&=A-\frac{B}{C+T}\\[3pt]
\frac{B}{C+T}&=A-\ln P\\[3pt]
B&=\left( A-\ln P\right) \left( C+T\right) \\[3pt]
C+T&=\frac{B}{A-\ln P}\\[3pt]
T&=\frac{B}{A-\ln P}-C\\[3pt]
T&=\frac{2788.51}{20.7936-\ln 63000}-\left( -52.36\right) \\[5pt]
&=338.6\ \textrm{K}\\[5pt]
&=65.4\ \textrm{℃}\end{aligned}$$
よって、アントワン係数の適用温度範囲内(280-377 K)でしたので、富士山の山頂(気圧63 kPa)における、ベンゼンの沸点は65.4℃となることがわかりました。
計算例②
【問題】
沸点160℃(433 K)の飽和水蒸気の圧力は何 MPaでしょうか。
アントワン係数は、前章の「アントワン係数一覧」の表を参照してださい。
【解答】
(2)式にアントワン係数と温度を代入して求めます。
$$\begin{aligned}P&=\exp \left( A-\frac{B}{C+T}\right) \\[3pt]
&=\exp \left( 23.1964-\frac{3816.44}{-46.13+433}\right) \\[3pt]
&=6.16\times 10^{5}\ \textrm{Pa}\\[5pt]
&=616\ \textrm{kPa}\\[5pt]
&=0.62\ \textrm{MPa}\end{aligned}$$
圧力が高くなると、沸点が上昇するね!

まとめ
ポイント
- 蒸気圧とは、分子の運動により液体が気体になろうとする力(圧力)のこと。
- 蒸気圧は、温度が高ければ高いほど大きくなる。
- 蒸気圧は、物質によって異なる。
- 沸点とは、蒸気圧と圧力が一致する温度のこと。
- 蒸気圧が大きい物質ほど沸点が低い。
- 外圧が高いと沸点は上昇し、外圧が低いと沸点は低下する。
- 蒸気圧はアントワンの式で求めるのが一般的。
参考文献
化学工学便覧(改定7版)を買うと、改定6版のPDF(CD-ROM)がついてきます。
PDFの検索機能が使えるので、物性値を探すときなどに非常に重宝します。
Perry's Chemical Engineers' Handbookは、英語版の化学工学便覧のようなものです。
7th Editionならば、こちらのサイトで無料で見ることができます。
Perry's Chemical Engineers' Handbook, 7th Edition (English Edition)
その他にも、
などの名著も無料で見れますので、英語が苦でない方はこちらで勉強するのもありかなと思います。
ちなみに、私はこのサイトの存在を知らず、買ってしまいました(泣)
蒸気圧が理解できたら、次は「気液平衡」について理解していきましょう。
気液平衡が理解できれば、蒸留理論が理解できるようになります。
-

-
【ラウールの法則】気液平衡とは?(理想溶液編)
続きを見る